Penny Hatzimanolakis
Département des sciences biologiques et médicales de santé buccodentaire, Université de la Colombie-Britannique, Vancouver, Colombie-Britannique, Canada.
Correspondance : Penny Hatzimanolakis, Hygiéniste dentaire diplômée, B. Sc. (médecine dentaire), M. Sc., professeure agrégée d’enseignement clinique à l’Université de la Colombie-Britannique, adresse électronique : pennyhat@dentistry.ubc.ca
Le rapport sur le marché mondial des implants dentaires de 2021 prévoyait une croissance de 4,486 milliards de dollars avec un taux de croissance annuel composé (TCAC) de 8,7 %1,2, ce qui explique pourquoi plus de 500 exposants d’implants dentaires sont inscrits au International Dental Show (IDS) cet automne (2021). L’expansion du marché mondial et la montée en puissance de multiples conceptions et composantes d’implants rendent, à juste titre, les protocoles de bonnes pratiques laborieux pour tous les cliniciens.
La planification, le placement et la restauration des implants sont essentiels au succès, mais la gestion de l’implant s’oriente rapidement vers le praticien en hygiène dentaire pour garantir sa pérennité. L’objectif de cet article est d’élucider les caractéristiques anatomiques des tissus péri-implantaires et de reconsidérer la gestion du biofilm afin de mieux soutenir la prise de décision des cliniciens dans la réalisation d’une approche de soins axée sur le patient.
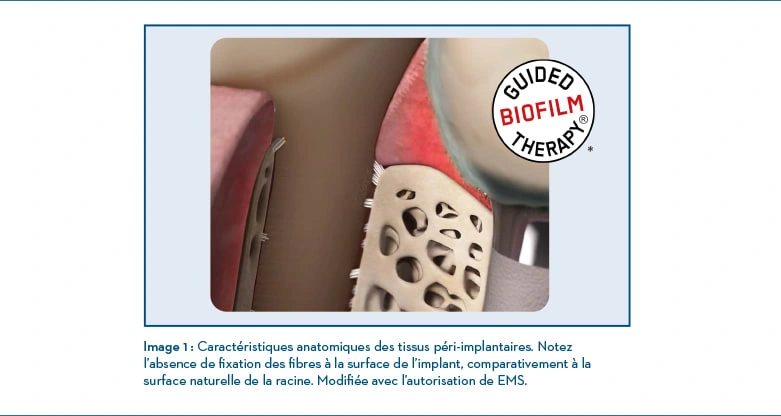
Caractéristiques anatomiques des tissus péri-implantaires Bien que similaires à la santé parodontale autour des dents naturelles, les caractéristiques anatomiques des péri-implants et ses fonctions ont des différences structurelles considérables. En particulier, l’implication avec les tissus environnants des implants et l’attachement biologique3
D’origine grecque, le terme péri qui signifie « autour » ou « entourant » est la zone autour de l’implant/pilier qui est composé d’une zone de tissu mou, la muqueuse péri-implantaire, qui se forme lors du processus de cicatrisation de la blessure4, et la zone de tissu dur, formant l’attachement à la surface de l’implant pour atteindre la stabilité de l’implant4. De plus, la muqueuse péri-implantaire face à l’implant/pilier contient deux sections séparées5, une zone coronale doublée d’une barrière d’épithélium mince non kératinisée et d’un épithélium sulculaire, et une zone apicale dans laquelle le tissu conjonctif semble être en contact avec la surface de l’implant. Cette section apicale de la muqueuse péri-implantaire, bien que controversée, est désignée zone d’adhérence/d’appui du tissu conjonctif et peut présenter une variation entre 1 et 2 mm6
Les différences considérables entre les tissus parodontaux et péri-implantaires sont pertinentes pour comprendre les modèles destructeurs potentiels. Le jugement professionnel dans le choix d’un instrument (évaluation ou débridement) ou de produits buccodentaires personnels pour l’entretien d’implants/piliers doit respecter les biomatériaux de l’implant/pilier, la biologie du tissu péri-implantaire, étant donné sa double fonction de protection de l’os sous-jacent et de l’implant de soutien osseux5, et de réduire le caractère invasif7 à la doublure mince et les zones d’adhérence minimale.
Étiologie et microbiologie des infections des tissus péri-implantaires
La maladie parodontale est multifactorielle, et les infections/maladies des tissus péri-implantaires sont susceptibles de présenter des risques comparables. Le microbiome buccal d’un individu est soit symbiotique, c’est-à-dire commensal et vital pour des tissus dentaires mous et durs sains, ou dysbiotique, c’est-à-dire des communautés déséquilibrées qui provoquent une réponse inflammatoire de l’hôte qui est corrélée aux pathologies liées aux microbes comme les infections péri-implantaires8. L’étiologie primaire des infections péri-implantaires d’un point de vue biologique est le changement d’un environnement écologique vers un biofilm dysbiotique. Les pathogènes constituant une clé de voûte comme le Porphyromonas gingivalis peuvent perturber toutes les espèces, pathogènes ou pas, dans une communauté dysbiotique collective et inflammatoire8 et peuvent endommager les tissus péri-implantaires. L’exposition constante aux micro-organismes dans le microbiome buccal pose un défi à la muqueuse péri-implantaire, y compris l’adhérence (joint). Les données de Tomasi et coll.9 suggèrent que les bactéries entourant les implants dentaires exposés forment un microbiome diversifié, peu importe le profil parodontal des patients.
La classification péri-implantaire : façonner les recommandations du clinicien pour améliorer les résultats des patients
La classification inaugurale AAP/EFP des implants présente un flux de travail pour le diagnostic des cas cliniques3. La santé péri-implantaire est l’absence d’inflammation des tissus et une perte osseuse supplémentaire après la guérison initiale. En revanche, la péri-mucosite se manifeste par une inflammation tissulaire combinée à une perte osseuse supplémentaire après la guérison initiale, et la péri-implantite, l’évolution de la maladie, a un changement défavorable dans la profondeur du sondage, la présence d’inflammation des tissus combinée à une preuve radiologique de perte osseuse après la guérison initiale3
Gestion du biofilm péri-implantaire Les plans de soins des patients visent à prévenir, à arrêter ou à réduire la progression de la maladie en incorporant les meilleures pratiques pour atténuer l’inflammation péri-implantaire, à la fois professionnellement et essentiellement par des routines quotidiennes personnelles d’hygiène buccodentaire entreprises par le patient.
Le modèle accepté de maladie parodontale implique que le processus comprend un changement vers un biofilm dysbiotique, commençant l’inflammation et entraînant une infection. Toutefois, dans un modèle proposé, il y a des preuves qui suggèrent que l’inflammation est l’initiateur, c’est-à-dire que l’inflammation déclenche le processus et qu’elle est responsable du changement du biofilm écologique, entraînant une infection non seulement dans les maladies parodontales, mais également dans d’autres conditions inflammatoires systémiques10
Quoique la perturbation mécanique du biofilm demeure la norme par excellence et qu’elle est réalisée de façon sécuritaire auprès de patients atteints de péri-implantite qui utilisent des brosses à dents électriques au mécanisme d’oscillation-rotation et des appareils interdentaires11, la topographie de l’implant dentaire peut comporter des risques et elle peut, en soi, s’avérer inadéquate pour la prévention ou pour le traitement de l’inflammation. Et qu’en est-il des agents thérapeutiques dans les produits de soins personnels? Sont-ils tous pareils?
La prescription de routines de soins personnels, de produits ou d’agents spécifiques doit être individuelle, efficace, sécuritaire et doit empêcher l’altération de l’intégrité de la surface de l’implant. Elle doit aussi comporter des biomatériaux qui ne se dégradent pas. La partie la plus importante est qu’elle doit soutenir les tissus péri-implantaires dans un microbiome en symbiose (sain) dans le but de réduire le risque d’un changement du biofilm écologique.
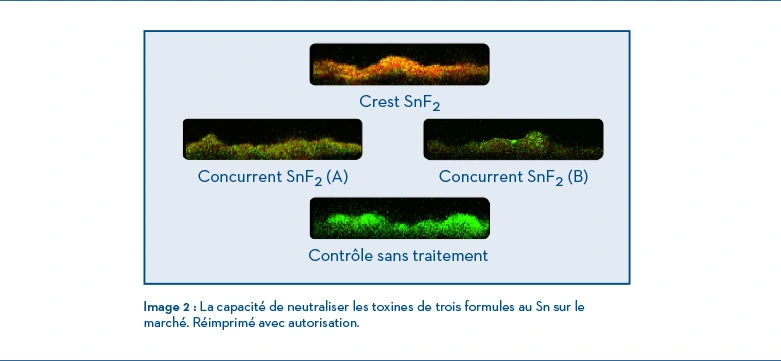
L’utilisation d’un dentifrice composé de fluorure stanneux stabilisé (SnF2) peut perturber le biofilm, car il y a une réduction de la production métabolique de toxines12, ce qui supprime directement les facteurs de virulence des pathogènes13, avec une pénétration sous-gingivale allant jusqu’à 4 mm dans le cas de dents naturelles14. Biesbrock A et coll. ont démontré qu’il y a 3,7 fois plus de chances de passer à des gencives généralement saines (< 10 % de zones de saignement) comparativement à l’utilisation d’un dentifrice de contrôle négatif au fluorure de sodium (ou MFP) en utilisant la formule au SnF215. Lors d’une étude in vitro, la formule au pH presque neutre a démontré l’absence de corrosion sur l’alliage de titane et qu’elle était aussi sécuritaire que le fluorure de sodium16
Afin de soutenir la prise de décision critique lors de la sélection de la méthodologie pour les routines de soins personnels des professionnels ou des patients, celles-ci doivent être alignées avec : 1) qu’est-ce que la santé du tissu péri-implantaire, 2) quelle est l’étiologie et les facteurs qui y contribuent, 3) quelle méthodologie permettra de soutenir la perturbation et la gestion thérapeutique du biofilm, et 4) quelle méthodologie va respecter la biologie du biofilm des tissus péri-implantaires sans être effractive.
Conclusion
Les praticiens de l’hygiène dentaire doivent s’y connaître en matière des principes fondamentaux de la conception d’implants dentaires, des piliers, des caractéristiques et des fonctions des tissus péri-implantaires afin d’identifier correctement les maladies liées aux implants. Tout comme avec les patients souffrant de parodontite, les nouveaux protocoles et les protocoles d’entretien doivent inclure toutes les évaluations de risques, dont les déterminants sociaux de la santé, la gestion du biofilm guidée par un professionnel, les produits et les routines de soins personnels efficaces et les soins de suivi réguliers, ce qui peuvent grandement influencer le succès d’un implant dentaire et sa survie.
https://www.ems-dental.com/fr/guided-biofilm-therapy
References: 1. https://www.reportlinker.com/p06071073/Dental-Implants-Global-Market-Report-COVID-19-Growth-And-Change-to.html?utm_source=GNW. 2. Elani HW, Starr JR, DaSilva JD, Gallucc3i GO. Trends in Dental Implant Use in the U.S., 1999-2016, and Projections to 2026. J Dent Res. 2018; 97(13):1424-1430. doi: 10.1177/0022034518792567. 3. Renvert S, Persson GR, Pirih FQ, Camargo PM. Peri-implant health, peri-implant mucositis, and peri-implantitis: Case definitions and diagnostic considerations. J Clin Periodontol. 2018;45:S278-S285. 4. Berglundh T, Abrahamsson I, Welander M, Lang NP, Lindhe J. Morphogenesis of the peri-implant mucosa: an experimental study in dogs. Clin Oral Implants Res;2007;18:1–8. 5. Araujo MG., Lindhe J. Peri-implant health. J Clin Periodontol. 2018;45:S249-S256. 6. Larjava H, Koivisto L, Hakkinen L, Heino J. Epithelial Integrins with Special Reference to Oral Epithelia. J Dent Res. 2011 Dec; 90(12): 1367–1376. doi: 10.1177/0022034511402207. 7. Saadoum AP, Touati B. Soft Tissue Recession around Implants: Is it still unavoidable? -Part II. Pract Proced Aesthet Dent. 2007;19(2):81-87. 8. Cortés-Acha B, Figueiredo R, Seminago, et al. Microbiota Analysis of Biofilms on Experimental Abutments Mimicking Dental Implants: An In Vivo Model. J Periodontol. Oct 2017; 88(10):1090-1104. 9. Tomasi C, Tessarolo F, Caola I, et al. Early healing of peri-implant mucosa in man. J Clin Periodontol. 2016;43:816–82. 10. Van Dyke TE. Shifting the paradigm form inhibitors of inflammation to resolvers of inflammation in periodontitis. J Periodontol. Oct 2020; volume 91 (Number S1) pgs: S19. 11. Vandekerckhove, B., Quirynen, M., Warren, P.R. et al. The safety and efficacy of a powered toothbrush on soft tissues in patients with implant-supported fixed prostheses. Clin Oral Invest 8, 206–210 (2004). 12. 4 Cannon M, Khambe D, Klukow-ska M, Ramsey D, Miner M, Huggins T, White DJ. Clinical effects of stabilized stannous fluoride dentifrice in reducing plaque microbial virulence II: Metabonomic changes. J Clin Dent 2018;29:1–12. 13. Klukowska M, Haught JC, Xie S, Circello B, Tansky CS, Khambe D, Huggins T, White DJ. Clinical effects of stabilized stannous fluoride dentifrice in reducing plaque microbial virulence I: Microbiological and receptor cell findings. J Clin Dent 2017;28:16-26. 14. Tao et al. Assessment of the Effects of a Novel Stabilized Stannous Fluoride Dentifrice on Gingivitis in a Two-Month Positive-Controlled Clinical Study J Clin Dent. 2017 Dec;28(4 Spec No B): B12-16. 15. Biesbrocck A, et al. The effects of bioavailability gluconate chelated stannous fluoride dentifrice on gingival bleeding: Meta-Analysis of eighteen randomized controlled trials. J Clin Periodontol (2019) December. 16. Suszcynsky-Meister E et al. J Dent Res (2018) 97 (Spec Iss A): Abstract 994.





![[FR] - Generic Page - Penny Hatzlmanolakis – Peri-Implant Maintence - Image Layout 3 - Image Item 2](http://images.ctfassets.net/nglyjmvvpp62/3xMV5RS7eRSEP69ZCLhy76/ac00d55a9dabf559312ab8d8705a6074/Peri-Implant_RelatedArticle-2_FR_jpg.jpg)
